UDI & Serialisierung für Medizinische Geräte
Die Frist für die Einführung der Rückverfolgbarkeit für Medizinprodukte in der Europäischen Union rückt näher. Bis Ende 2027 müssen Produkte mit hohem Risiko (Klasse 3) mit einer UDI gekennzeichnet werden, und bis Ende 2028 müssen auch Produkte mit geringem und mittlerem Risiko (Klasse 1 und 2) diese Anforderungen erfüllen.
UDI Hintergrund
UDI steht für „Unique Device Identification” und bezieht sich auf medizinische Geräte. Dazu haben die US Behörde FDA und die EMA der Europäischen Union jeweils Gesetze auf den Weg gebracht. Diese betreffen die komplette Palette der Medizingeräte von
Klasse 1 (geringes Risiko, wie Bandagen etc.) über
Klasse 2 (mittleres Risiko, z.B. Hörgeräte, Katheter) bis zu
Klasse 3 (Hochrisikogeräte für lebenserhaltende Maßnahmen, z.B.: Herzschrittmacher).
Die UDI-Verordnung verlangt, dass das medizinische Gerät selbst sowie alle höheren Verpackungsstufen (nicht die Logistikeinheiten) mit einem eindeutigen UDI-Code in maschinenlesbarem (Barcode) und menschenlesbarem Format gekennzeichnet werden müssen. Eine Direktkennzeichnung auf dem Produkt selbst ist für solche Medizinprodukte erforderlich, die für eine wiederholte Verwendung über einen langen Zeitraum bestimmt sind und mehrfach aufbereitet werden, da diese zwangsläufig von der Originalverpackung getrennt werden. Um die UDI Codierung aufzubringen, stehen abhängig vom Material verschiedene Technologien (Thermal Ink Jet, Thermo Transfer oder Laser) zur Verfügung.
Ziele der UDI-Verordnung
- Einrichtung eines Systems zur angemessenen Identifizierung von medizinischen Geräten durch die Lieferkette und bei deren Verwendung.
- Zugriff auf wichtige und umfangreiche Informationen rund um das medizinische Gerät.
- Möglichkeit zur standardisierten Dokumentation der Verwendung von medizinischen Geräten in elektronischen Patientenakten.
Jede Behörde hat dazu eine Datenbank erstellt. In den USA ist dies die GUDID und in der Europäischen Union die EUDAMED Datenbank. Der Hersteller ist nun gefordert jedes Produkt mit seinen korrespondierenden Datenelementen in der Behördendatenbank zu registrieren.
Aufbau des UDI-Codes

Die Begriffe und Abkürzungen rund um die UDI-Regulierung können sehr verwirrend sein.
Hier zunächst einige Definitionen:
UDI = „Unique Device Identification“ – die Codierung auf dem Produkt; entspricht dem GS1 Standard. UDI besteht aus DI + PI
DI = „Device Identifier“ – Global Trade Item Number (GTIN)
PI = „Production Identifier” – Weitere produktionsrelevante Identifier wie
- Lot: AI(10),
- Verfallsdatum: AI(17) oder auch
- Seriennummer: AI(21)
Welche Informationen Verwendung finden, liegt ganz beim Hersteller.
=> die UDI Codierung besteht also aus der GTIN und den optionalen produktionsrelevanten Informationen.
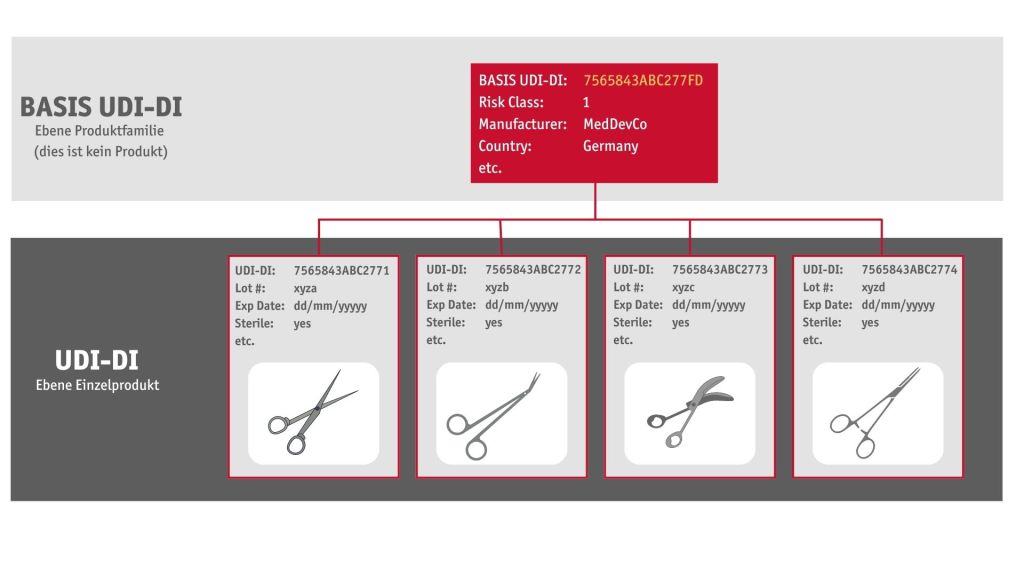
Im Unterschied zu den USA wird für Europa zusätzlich noch die „Basis UDI-DI“ benötigt. Die „Basis UDI-DI“ kennzeichnet eine gesamte Produktfamilie. Neben derselben „Basis UDI-DI“ besitzt jedes einzelne Produkt aus dieser Produktfamilie eine eigene eindeutige Nummer. Diese Nummer ist die UDI-DI. Die „Basis UDI-DI“ erscheint in der EUDAMED-Datenbank und in den offiziellen Dokumenten. Sie erscheint nie auf dem Produkt oder dessen Verpackung.
Die UDI-DI (GTIN) erscheint in der EUDAMED-Datenbank und auf den Produkten und/oder ihrer Verpackung. Anhand der UDI-DI (GTIN) wird dann in der Behördendatenbank das Produkt identifiziert und dem Anfragendem alle Produktinformationen zur Verfügung gestellt.
Regularien: Medizinische Geräte vs. Pharma
Im Allgemeinen ist Track & Trace derzeit nur bei pharmazeutischen Produkten erforderlich. Durch den Einsatz und die Nutzung eines Identifikationssystems werden Unternehmen, die Arzneimittel und Medizinprodukte herstellen, zu Trägern der Informationen die für Track & Trace erforderlich sind. Diese Informationen können verwendet werden, um jeden einzelnen Artikel zu identifizieren. Es gibt aber bereits Initiativen die an einer Empfehlung arbeiten, medizinische Geräte genauso wie pharmazeutische Produkte zu behandeln. Wir glauben, dass die Hersteller von medizinischen Geräten in naher Zukunft das pharmazeutischen Modell übernehmen werden und die Produktverfolgungsinformationen automatisieren müssen.
Daher empfehlen wir allen Hersteller von medizinischen Geräten bereits heute den Einsatz eines Laetus Track & Trace Systems, auch dann wenn es noch keine direkte Serialisierungsanforderungen gibt. Die Firma Laetus verfügt über jahrzehntelange Erfahrung im pharmazeutischen Bereich und ist mit ihrem großen pharmazeutischen Kundenstamm der ideale Partner für Ihre ersten Schritte im Bereich Track & Trace.
Insbesondere für Hersteller großer Stückzahlen, mit zahlreichen Produktionslinien an mehreren Standorten, macht es Sinn ein übergeordnetes System einzusetzen, welches Aufträge automatisch an die Produktionslinien verteilt und die jeweiligen Drucker und Kameras mit den richtigen Daten versorgt. Fehler durch Laden eines falschen Layouts durch den Bediener werden eliminiert. Das System kann direkt mit Ihrem ERP kommunizieren um Auftragsdaten zu empfangen, abzuarbeiten und zurückzumelden. Einheitliche Protokolle und Änderungsaufzeichnungen erhöhen die Qualität der Produktion.
Warum Serialisierung doch Sinn macht
Serialisierung und Aggregation machen das Produkt durch die gesamte Lieferkette verfolgbar. Gerade bei hohem Durchsatz ist es wichtig zu wissen wie viele Produkte produziert wurden und wo in der Kette sich diese befinden. Die Rückverfolgbarkeit von Produkten bringt somit einen enormen internen Mehrwert mit sich.
Gefragt ist ein System das sowohl für UDI-Regularien, als auch für Pharma Regularien einsetzbar ist und die höchst mögliche Flexibilität mit sich bringt. Es ist also sinnvoll, bei der Auswahl eines Systems zur Unterstützung der Serialisierung, die UDI Anforderungen gleich miteinzubeziehen und umgekehrt. Wenn dann eine zukünftige Anforderung zur Automatisierung des Informationsaustauschs erlassen wird, kann die für Arzneimittel erstellte Serialisierungsstruktur auch für Medizinprodukte verwendet werden. Wir empfehlen einen ganzheitlichen Ansatz für die Entwicklung Ihres UDI-Systems, da die Sicherheit der Lieferkette und mögliche Fälschungen ein ständiges Problem sein werden.
Schlussfolgerung
Zusammenfassend sollten Organisationen ihre UDI-Implementierungsstrategie unter Berücksichtigung des Gesamtbildes entwickeln und Lösungen entwerfen, die die unmittelbaren Anforderungen erfüllen, aber auch die potenziellen Track & Trace Anforderungen berücksichtigen. Der Aufbau einer flexiblen Lösung kann kurzfristig eine größere Investition erfordern, wird aber später erhebliche Einsparungen bringen.